"Tu sei quello che mangi" - ma come si determina?
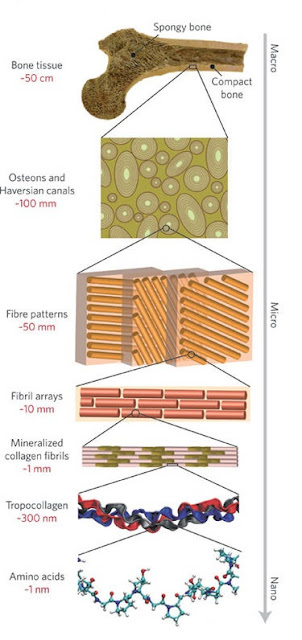 |
| La figura (modified from Ritchie, 2011) mostra in maniera schematica l'organizzazione del collagene nel tessuto osseo. |
Qualche tempo fa vi avevamo introdotto allo studio dei rapporti isotopici del carbonio e dell’azoto nel collagene per le indagini riguardanti la dieta . Oggi riprendiamo il discorso, che non eravamo riusciti a coprire del tutto, esaminando il protocollo più comune di estrazione e di analisi.
Cos’è il collagene? E perché proprio questo materiale? Il collagene è una proteina costituita da più fibrille di tropocollagene, con conformazione a tripla elica, unite da legami covalenti. È reputato un materiale ideale nelle indagini isotopiche di paleodieta per diverse ragioni. Innanzitutto, è la proteina più abbondante negli animali: del 20% di materia organica che costituisce l’osso (l’altro 80% è costituito da componenti inorganiche), il 18% è rappresentato da collagene. Ha la caratteristica di essere insolubile in acqua e, sebbene i meccanismi di degrado siano molto complicati, soprattutto in seguito a seppellimento, si trova nelle ossa anche dopo moltissimo tempo in condizioni di temperatura e pH favorevoli (Collins et al., 2002). Inoltre, un attento protocollo di estrazione permette di isolare collagene originario e non contaminato (Van Klinken, 1999).
Il protocollo più comunemente utilizzato per l’estrazione del collagene si basa sul modello originale proposto da Longin (1971) e successivamente modificato da Brown e colleghi (1988) con eventuali ulteriori modifiche apportate dal laboratorio in questione. Questo prevede il campionamento, la pulitura del campione, la sua demineralizzazione, la gelatinizzazione del collagene estratto e la liofilizzazione. Brevemente, un campione di osso compatto (da preferire a quello spugnoso perché quest’ultimo ha un contenuto di collagene molto basso), generalmente non superiore ai 500 mg, viene pulito da eventuali residui di materiale di deposizione, consolidanti (per esempio Paraloid® B72) e inchiostro da siglatura con l’aiuto di un sandblaster o manualmente, a seconda dello stato di conservazione dell’osso. L’osso, così pulito, viene lasciato reagire con una soluzione 0.5 M di acido cloridrico (HCl) (che può essere diluito in caso di campioni mal preservati) a +4 °C, generalmente fino a 48 ore, tempo che varia sensibilmente a seconda del contesto archeologico da cui proviene il campione e/o dalla specie di appartenenza, fino anche a poche settimane. L’HCl rompe i legami covalenti tra le fibrille di tropocollagene, lasciando però invariata la struttura di quest’ultima, che rimane nella sua conformazione caratteristica di tripla elica. Quando il campione risulta deformabile, traslucido e galleggia, si passa alla fase successiva, la gelatinizzazione. Questa fase comporta la dissociazione delle catene del tropocollagene, dopo una permanenza di 48 ore del campione a +80 °C. Il liquido che ne rimane, contenente il prezioso materiale, viene riposto in freezer alla temperatura di -20°C per 48 ore, e successivamente liofilizzato. Il collagene, al termine della procedura, avrà raggiunto una conformazione spumosa e lattiginosa.
E ora la parte difficile: l’analisi attraverso l’Isotope Ratio Mass Spectrometry (IRMS), il quale non è altro che uno spettrometro di massa a cui è associato un analizzatore elementare che prepara il campione (generalmente in forma gassosa), ne divide i componenti (nel caso della forma gassosa, attraverso una colonna cromatografica) e li purifica. Le molecole costituenti il campione vengono iniettate nello spettrometro, che le ionizza e le separa attraverso campi magnetici statici o oscillanti a seconda del loro rapporto massa/carica (m/z). Ci saranno certamente nuove occasioni per approfondire la spettrometria di massa. Per ora, in questa sede, ci basta sapere che le molecole vengono rilevate come 14N2, 14N15N e 15N2 di unità di massa atomica (UMA) rispettivamente 28, 29 e 30. Il carbonio si presenta invece nelle forme 12C16O2, 13C16O2 e 12C16O18O (UMA 44, 45 e 46), sebbene quest’ultima specie sia talmente rara da essere generalmente trascurata. Queste specie danno luogo a picchi diversi nello spettro e l’intensità dei picchi è proporzionale alla loro concentrazione. Il Dalton (Da) è l’unità di massa ed è pari a 1/12 della massa del 12C. L’unità di carica usata è pari alla carica dell’elettrone e, poiché in gran parte dei casi gli ioni hanno una sola carica, il rapporto m/z è numericamente uguale alla massa espressa in Da. Le concentrazioni degli isotopi vengono misurate facendo riferimento a degli standard di riferimento internazionali, che sono il Vienna Pee Dee Belemnite (VPDB) per il rapporto isotopico (R) 13C/12C e aria (AIR) per il rapporto isotopico (R) 15N/14N. Esse vengono espresse in ’parti per mille’ (‰) con il simbolo δ, come già spiegato precedentemente . Una volta assicurataci la bontà dei dati ottenuti, siamo pronti per procedere con la parte più divertente: la realizzazione di grafici e interpretazione dei dati, sempre con l’aiuto di un professionista archeologo che ci aiuti a contestualizzare il dato ottenuto.
Silvia
Bibliografia essenziale
Brown, T.A., Nelson, D.E., Vogel, J.S. and Southon, J.R., 1988. Improved collagen extraction by modified Longin method. Radiocarbon, 30(2), pp.171-177.
Collins, M.J., Nielsen–Marsh, C.M., Hiller, J., Smith, C.I., Roberts, J.P., Prigodich, R.V., Wess, T.J., Csapo, J., Millard, A.R. and Turner–Walker, G., 2002. The survival of organic matter in bone: a review. Archaeometry, 44(3), pp.383-394.
Longin, R., 1971. New method of collagen extraction for radiocarbon dating. Nature, 230(5291), p.241.
Ritchie, R.O., 2011. The conflicts between strength and toughness. Nature materials, 10(11), p.817.
Ritchie, R.O., 2011. The conflicts between strength and toughness. Nature materials, 10(11), p.817.
Van Klinken, G.J., 1999. Bone collagen quality indicators for palaeodietary and radiocarbon measurements. Journal of Archaeological Science, 26(6), pp.687-695.


Commenti
Posta un commento